Des De Los Alcanos Alquenos Y Alquinos 6fpd
This document was ed by and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this report form. Report 3b7i
Overview 3e4r5l
& View Des De Los Alcanos Alquenos Y Alquinos as PDF for free.
More details w3441
- Words: 2,058
- Pages: 7
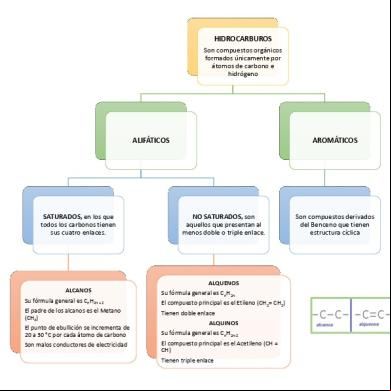
También se conoce como química del carbono porque este elemento está presente en todas sus moléculas. Hay una serie de elementos que forman parte principalmente de estos compuestos: Carbono (C), Hidrógeno (H), Oxígeno (O), Nitrógeno (N). El carbono (C) tiene 4 electrones en la capa de valencia. Por tanto va a formar siempre 4 enlaces covalentes. Los enlaces pueden ser: simples, dobles y triples. El carbono puede unirse con otros carbonos formando de esta manera cadenas de compuestos carbonados. El hidrógeno solo tiene un electrón formando un enlace covalente simple. Los compuestos orgánicos se representan mediante una fórmula que puede ser empírica, molecular y estructural. Empírica: Con/En la empírica se expresa la proporción en la que están los distintos elementos. Molecular: Indica el número de átomos totales del compuesto. Estructural: Indica todos los enlaces que existen en la molécula.
Como la fórmula estructural es muy larga se suele escribir de una manera más simplificada. CH3-CH=CH-CH3 Isomería: Dos compuestos orgánicos son isómeros si tienen la misma forma molecular y distinta fórmula estructural. Esto implica que sus propiedades van a ser diferentes. Hidrocarburos: Son compuestos orgánicos formados solamente por carbono e hidrógeno. Podemos clasificarlos en: Alcanos, Alquenos y Alquinos. Alcanos: En ellos todos los enlaces Carbono-Carbono (C-C) son simples. Alquenos: En ellos hay al menos un enlace doble. Alquinos: En ellos hay al menos un enlace triple.
Alcanos Nomenclatura de los Alcanos: - Se cuenta el número de Carbonos de la cadena y se le asigna una raíz en función del número de estos. 1 2 3 4
Carbono: Carbono: Carbono: Carbono:
metetpropbut-
5 Carbono: pent...
- Se le añade el sufijo -ano - Si existen cadenas ramificadas, utilizamos los siguientes criterios: * * * * *
Tomamos como cadena principal a la que mayor número de carbonos tenga. Asignamos a cada átomo de "C" de la cadena un número localizador. Comenzamos a contar por el extremo que tenga más próxima la rama. Se nombran anteponiendo el localizador al nombre del hidrocarburo. Los nombres de los sustituyentes añadiendo al nombre de la raíz el sufijo -il o -ilo.
- Si aparecen más de un radical (o más de un sustituyente), hemos de nombrar a todos por orden alfabético. Si se repite alguno se le añade el prefijo di-.
Propiedades físicas y químicas de los alcanos Propiedades Físicas Puntos de ebullición suelen ser bajos y crecen al aumentar la longitud de la cadena. Esto explica que el propano sea gas y el hexano líquido. Los alcanos son insolubles y son gases a temperatura ambiente de bajo peso molecular. Propiedades Químicas Los alcanos reaccionan muy poco. La combustión puede ser completa o incompleta. La combustión es completa cuando el oxígeno es abundante. La combustión es incompleta cuando el oxígeno es escaso
Peligros de la combustión Incompleta * El CO es tóxico. * Reacciona con la hemoglobina de la sangre impidiendo que esta sea transportada con oxígeno a la sangre. * Puede dar lugar a partículas de carbón no quemadas (este hollín que se deposita en las chimeneas y a la larga puede provocar incendios).
Peligros de la combustión completa * La combustión completa produce dióxido de carbono (CO2). Este gas ocasiona junto a otros como el metano el efecto invernadero. Este efecto, mantiene la temperatura de la tierra pues impide que salgan las radiaciones infrarrojas del suelo. Actualmente debido al aumento de las combustiones esta aumentando la concentración de CO2 en la atmósfera.
Fuentes de hidrocarburos * El petróleo: Se obtiene los distintos hidrocarburos por destilación. Al llegar a una refinería se somete al petróleo a una destilación fraccionada, separándolo en distintas fracciones en función de su punto de ebullición. Puede suceder que las cantidades obtenidas de alguna fracción sean insuficientes por lo tanto procede a realizar nuevos procesos, entre ellos está el craqueo (cracking). El craqueo consiste en romper cadenas largas, obteniendo otras mas pequeñas que sean más útiles. Suele realizarse por medio de calor o en presencia de catalizadores. * Gas Natural: Es también un combustible fósil que esta formado principalmente por metano (CH4). Se emplea fundamentalmente para la producción de energía porque es un gas que contamina menos que el
carbón pero que también contribuye al aumento de la concentración de CO2. Este metano también puede obtenerse de la descomposición de la materia viva.
Alquenos Los alquenos son hidrocarburos que tienen un doble enlace carbono = carbono (C=C) en su estructura.
Nomenclatura de los Alquenos: * La cadena principal es la que tiene mayor número de dobles enlaces. * Se empiezan a contar los localizadores de forma que el número que asignemos al enlace sea el menor. * Se nombran igual que los alcanos sustituyendo el sufijo -ano por -eno indicando el localizador del doble enlace.
Propiedades físicas y químicas de los alquenos Propiedades físicas Son similares a las de los alcanos
Propiedades químicas Debido a la presencia del doble enlace estos compuestos son mucho más reactivos que los alcanos. Entre las reacciones más características, se encuentran: * La adición al doble enlace. Se le añade una molécula rompiendo el doble enlace. * Polimerización. Los alquenos pueden polimerizarse fácilmente, para ello al calentarlos y en presencia de catalizadores se rompe el doble enlace formando unas especies químicas inestables. Estas especies químicas se unen entre sí, formando largas cadenas que son los polimeros.
ALCANOS Propiedades físicas: Los 4 primeros de la serie son gases, del pentano (C5) al hexadecano (C16), líquidos, y los superiores son sólidos, (parafinas). Los grupos de hidrocarburos se caracterizan por su poca reactividad (sonsustancias relativamente inertes), se utilizan como solventes y lubricantes. Características: a) Solubilidad: al ser sustancias no polares deben disolverse en solventes orgánicos no polares, son insolubles en la razón por lo cual se dice que son hidrofóbicos. b) Densidad: Su valor aproximado es de 0.7 g/ml, es menos denso que el agua. c) Punto de ebullición: Aumenta al aumentar el número de carbonos (masa molecular) d) Punto de fusión: Aumenta al aumentar la masa molecular, porque no tiene forma regular. Propiedades Químicas: La poca reactividad química de los alcanos a temperatura ambiente dió origen al nombre de parafinas, derivado del latín PARUM AFFINIS que significa poca afinidad. Los alcanos no son atacados por ácidos o bases fuertes, tampoco por agentes oxidantes o reductores. Sin embargo, los alcanos si reaccionan en condiciones severas y constituyen productos de gran
utilidad comercial. Las principales reacciones de los alcanos son: Combustión Los alcanos reaccionan con el oxígeno para producir dióxido de carbono, agua y calor. Pirólisis o cracking Es el proceso por medio del cual los hidrocarburos de alto peso molecular se rompen a altas temperaturas en presencia de un catalizador y en ausencia del oxígeno, para evitar la combustión. ALQUENOS Propiedades Fisicas Generales: Las propiedades físicas de los alquenos son similares a las de los alcanos correspondientes. Los alquenos más pequeños son gases a temperatura ambiente. Comenzando por los compuestos C5, los alquenos son líquidos volátiles. Los alquenos isómeros tienen puntos de ebullición parecidos y las mezclas sólo pueden ser separadas mediante una destilación fraccionada realizada con mucho cuidado y con columnas de gran eficacia. Los momentos dipolares son pequeños en el caso de los hidrocarburos, pero permite una distinción entre los isómeros cis y trans. Por ejemplo, el cis-2-buteno tiene un momento dipolar pequeño mientras que el trans-2-buteno tiene un momento dipolar nulo debido a su simetría. Algunas comparaciones Punto de ebullición.Los puntos de ebullición de los alquenos no ramificados aumentan al aumentar la longitud de la cadena.Para los isómeros,el que tenga la cadena más ramificada tendrá un punto de ebullición más bajo. Solubilidad.Los alquenos son casi totalmente insolubles en agua debido a su baja polaridad y a su incapacidad para formar enlaces con el hidrógeno. Estabilidad.Cuanto mayor es el número de grupos alquilo enlazados a los carbonos del doble enlace (más sustituido esté el doble enlace) mayor será la estabilidad del alqueno. Puntos de fusión, ebullición, momento dipolar Los alquinos tienen puntos de fusión y ebullición próximos a los de los correspondientes alcanos y alquenos. El triple enlace introduce una cierta polaridad en la molécula debido a que los carbonos sp son mas electronegativos que los sp3, generándose momentos dipolares. Los alquinos simétricos son apolares ya que se cancelan los momentos dipolares.
LOS ALQUENOS Los alquenos con dos, tres y cuatro átomos de carbono son gases, los alquenos lineales con mas de 16 carbonos son sólidos. · Son insolubles en agua. · Su densidad aumenta con el peso molecular Los alquenos también se llaman olefinas Los alquenos presentan las siguientes propiedades: Son solubles en disolventes orgánicos e insolubles en el agua. Sus estados físicos varían con el número de carbonos que componen el compuesto. A mayor peso molecular mayor son los puntos de ebullición y fusión, así como la densidad.
Nomenclatura Química Soluciones preparación y valoración Propiedades Coligativas Equilibrio Químico Equilibrio Ionico Estructura y propiedades de los compuestos químicos orgánicos Propiedades físicas y químicas de los hidrocarburos Propiedades Alcoholes Propiedades Feroles Propiedades Aminas Propiedades Aldehidos Cetona Propiedades Acidos Carboxilicos Derivados Halogenados Nomenclatura de los compuestos orgánicos Electroquímica Oxido - Reducción Cambios de Fase Energía Calorifica Enlace Químico Isometría
Propiedades físicas y químicas de los hidrocarburos Los hidrocarburos son compuestos orgánicos formados exclusivamente por carbono e hidrógeno.
Los hidrocarburos se clasifican en: Hidrocarburos saturados, llamados también alcanos, que presentan enlaces sencillos. Los alquenos, que tienen enlaces dobles Alcanos: Los átomos de carbono de un alcano pueden ser clasificados como: átomo primario cuando se unen a un carbono, secundario, si se unen a dos carbonos, terciario, si se unen a tres o cuaternario si se unen a cuatro.
LOS ALCANOS Punto de ebullición: el punto de ebullición aumenta con el tamaño del alcano porque las fuerzas intermoleculares (fuerzas de Van der Waals y de London), son más efectivas cuando la molécula presenta mayor superficie. Es así, que los puntos de fusión y ebullición van a aumentar a medida que se incrementa el número de átomos de carbono.
Los alcanos que se presentan a la izquierda, tienen el mismo número de carbonos pero sus puntos de ebullición son distintos. Esto se debe a que la superficie efectiva de o entre dos moléculas disminuye cuanto más ramificadas sean éstas. Las fuerzas intermoleculares son menores en los alcanos ramificados por ello tienen puntos de ebullición más bajos. Isomeros C5H12 Puntos de ebullición
Punto de Fusión Punto de fusión: El punto de fusión también aumenta con el tamaño del alcano por la misma razón que aumenta el punto de ebullición. Los alcanos con número impar de carbonos se empaquetan en una estructura cristalina y poseen puntos de ebullición un poco menores de lo esperados en los pares. Densidad: a medida que aumenta el número de carbonos, las fuerzas intermoleculares son mayores y por lo tanto la cohesión intermolecular. Esto da como resultando un aumento de la proximidad molecular y, por tanto, de la densidad.
Densidad del estado liquido Solubilidad: Los alcanos por ser compuestos apolares no se disuelven en agua, sino en solventes no polares como el benceno, éter y cloroformo. A temperatura ambiente es posible encontrar alcanos en diferentes estados físicos así: De metano a butano son gaseosos. De pentano a hexadecano son líquidos De heptadecano en adelante son sólidos.
Propiedades químicas de los alquinos: los alquinos terminales se comportan como ácidos porque, en presencia de bases fuertes, pueden ceder un protón. Alcanos: Los átomos de carbono de un alcano pueden ser clasificados como: átomo primario cuando se unen a un carbono, secundario, si se unen a dos carbonos, terciario, si se unen a tres o cuaternario si se unen a cuatro.
LOS ALQUINOS Como podría esperarse,las propiedades físicas de los alquinos son muy similares a las de los alquenos y los alcanos.Los alquinos son ligeramente solubles en agua aunque son algo más solubles que los alquenos y los alcanos.A semejanza de los alquenos y alcanos, los alquinos son solubles en disolventes de baja polaridad,como tetracloruro de carbono,éter y alcanos.Los alquinos, al igual que los alquenos y los alcanos son menos densos que el agua. Los tres primeros alquinos son gases a temperatura ambiente. Los alquinos tienen unas propiedades físicas similares a los alcanos y alquenos. Son poco solubles en agua, tienen una baja densidad y presentan bajos puntos de ebullición. Sin embargo, los alquinos son más polares debido a la mayor atracción que ejerce un carbono sp sobre los electrones, comparado con un carbono sp3 o sp2.
Como la fórmula estructural es muy larga se suele escribir de una manera más simplificada. CH3-CH=CH-CH3 Isomería: Dos compuestos orgánicos son isómeros si tienen la misma forma molecular y distinta fórmula estructural. Esto implica que sus propiedades van a ser diferentes. Hidrocarburos: Son compuestos orgánicos formados solamente por carbono e hidrógeno. Podemos clasificarlos en: Alcanos, Alquenos y Alquinos. Alcanos: En ellos todos los enlaces Carbono-Carbono (C-C) son simples. Alquenos: En ellos hay al menos un enlace doble. Alquinos: En ellos hay al menos un enlace triple.
Alcanos Nomenclatura de los Alcanos: - Se cuenta el número de Carbonos de la cadena y se le asigna una raíz en función del número de estos. 1 2 3 4
Carbono: Carbono: Carbono: Carbono:
metetpropbut-
5 Carbono: pent...
- Se le añade el sufijo -ano - Si existen cadenas ramificadas, utilizamos los siguientes criterios: * * * * *
Tomamos como cadena principal a la que mayor número de carbonos tenga. Asignamos a cada átomo de "C" de la cadena un número localizador. Comenzamos a contar por el extremo que tenga más próxima la rama. Se nombran anteponiendo el localizador al nombre del hidrocarburo. Los nombres de los sustituyentes añadiendo al nombre de la raíz el sufijo -il o -ilo.
- Si aparecen más de un radical (o más de un sustituyente), hemos de nombrar a todos por orden alfabético. Si se repite alguno se le añade el prefijo di-.
Propiedades físicas y químicas de los alcanos Propiedades Físicas Puntos de ebullición suelen ser bajos y crecen al aumentar la longitud de la cadena. Esto explica que el propano sea gas y el hexano líquido. Los alcanos son insolubles y son gases a temperatura ambiente de bajo peso molecular. Propiedades Químicas Los alcanos reaccionan muy poco. La combustión puede ser completa o incompleta. La combustión es completa cuando el oxígeno es abundante. La combustión es incompleta cuando el oxígeno es escaso
Peligros de la combustión Incompleta * El CO es tóxico. * Reacciona con la hemoglobina de la sangre impidiendo que esta sea transportada con oxígeno a la sangre. * Puede dar lugar a partículas de carbón no quemadas (este hollín que se deposita en las chimeneas y a la larga puede provocar incendios).
Peligros de la combustión completa * La combustión completa produce dióxido de carbono (CO2). Este gas ocasiona junto a otros como el metano el efecto invernadero. Este efecto, mantiene la temperatura de la tierra pues impide que salgan las radiaciones infrarrojas del suelo. Actualmente debido al aumento de las combustiones esta aumentando la concentración de CO2 en la atmósfera.
Fuentes de hidrocarburos * El petróleo: Se obtiene los distintos hidrocarburos por destilación. Al llegar a una refinería se somete al petróleo a una destilación fraccionada, separándolo en distintas fracciones en función de su punto de ebullición. Puede suceder que las cantidades obtenidas de alguna fracción sean insuficientes por lo tanto procede a realizar nuevos procesos, entre ellos está el craqueo (cracking). El craqueo consiste en romper cadenas largas, obteniendo otras mas pequeñas que sean más útiles. Suele realizarse por medio de calor o en presencia de catalizadores. * Gas Natural: Es también un combustible fósil que esta formado principalmente por metano (CH4). Se emplea fundamentalmente para la producción de energía porque es un gas que contamina menos que el
carbón pero que también contribuye al aumento de la concentración de CO2. Este metano también puede obtenerse de la descomposición de la materia viva.
Alquenos Los alquenos son hidrocarburos que tienen un doble enlace carbono = carbono (C=C) en su estructura.
Nomenclatura de los Alquenos: * La cadena principal es la que tiene mayor número de dobles enlaces. * Se empiezan a contar los localizadores de forma que el número que asignemos al enlace sea el menor. * Se nombran igual que los alcanos sustituyendo el sufijo -ano por -eno indicando el localizador del doble enlace.
Propiedades físicas y químicas de los alquenos Propiedades físicas Son similares a las de los alcanos
Propiedades químicas Debido a la presencia del doble enlace estos compuestos son mucho más reactivos que los alcanos. Entre las reacciones más características, se encuentran: * La adición al doble enlace. Se le añade una molécula rompiendo el doble enlace. * Polimerización. Los alquenos pueden polimerizarse fácilmente, para ello al calentarlos y en presencia de catalizadores se rompe el doble enlace formando unas especies químicas inestables. Estas especies químicas se unen entre sí, formando largas cadenas que son los polimeros.
ALCANOS Propiedades físicas: Los 4 primeros de la serie son gases, del pentano (C5) al hexadecano (C16), líquidos, y los superiores son sólidos, (parafinas). Los grupos de hidrocarburos se caracterizan por su poca reactividad (sonsustancias relativamente inertes), se utilizan como solventes y lubricantes. Características: a) Solubilidad: al ser sustancias no polares deben disolverse en solventes orgánicos no polares, son insolubles en la razón por lo cual se dice que son hidrofóbicos. b) Densidad: Su valor aproximado es de 0.7 g/ml, es menos denso que el agua. c) Punto de ebullición: Aumenta al aumentar el número de carbonos (masa molecular) d) Punto de fusión: Aumenta al aumentar la masa molecular, porque no tiene forma regular. Propiedades Químicas: La poca reactividad química de los alcanos a temperatura ambiente dió origen al nombre de parafinas, derivado del latín PARUM AFFINIS que significa poca afinidad. Los alcanos no son atacados por ácidos o bases fuertes, tampoco por agentes oxidantes o reductores. Sin embargo, los alcanos si reaccionan en condiciones severas y constituyen productos de gran
utilidad comercial. Las principales reacciones de los alcanos son: Combustión Los alcanos reaccionan con el oxígeno para producir dióxido de carbono, agua y calor. Pirólisis o cracking Es el proceso por medio del cual los hidrocarburos de alto peso molecular se rompen a altas temperaturas en presencia de un catalizador y en ausencia del oxígeno, para evitar la combustión. ALQUENOS Propiedades Fisicas Generales: Las propiedades físicas de los alquenos son similares a las de los alcanos correspondientes. Los alquenos más pequeños son gases a temperatura ambiente. Comenzando por los compuestos C5, los alquenos son líquidos volátiles. Los alquenos isómeros tienen puntos de ebullición parecidos y las mezclas sólo pueden ser separadas mediante una destilación fraccionada realizada con mucho cuidado y con columnas de gran eficacia. Los momentos dipolares son pequeños en el caso de los hidrocarburos, pero permite una distinción entre los isómeros cis y trans. Por ejemplo, el cis-2-buteno tiene un momento dipolar pequeño mientras que el trans-2-buteno tiene un momento dipolar nulo debido a su simetría. Algunas comparaciones Punto de ebullición.Los puntos de ebullición de los alquenos no ramificados aumentan al aumentar la longitud de la cadena.Para los isómeros,el que tenga la cadena más ramificada tendrá un punto de ebullición más bajo. Solubilidad.Los alquenos son casi totalmente insolubles en agua debido a su baja polaridad y a su incapacidad para formar enlaces con el hidrógeno. Estabilidad.Cuanto mayor es el número de grupos alquilo enlazados a los carbonos del doble enlace (más sustituido esté el doble enlace) mayor será la estabilidad del alqueno. Puntos de fusión, ebullición, momento dipolar Los alquinos tienen puntos de fusión y ebullición próximos a los de los correspondientes alcanos y alquenos. El triple enlace introduce una cierta polaridad en la molécula debido a que los carbonos sp son mas electronegativos que los sp3, generándose momentos dipolares. Los alquinos simétricos son apolares ya que se cancelan los momentos dipolares.
LOS ALQUENOS Los alquenos con dos, tres y cuatro átomos de carbono son gases, los alquenos lineales con mas de 16 carbonos son sólidos. · Son insolubles en agua. · Su densidad aumenta con el peso molecular Los alquenos también se llaman olefinas Los alquenos presentan las siguientes propiedades: Son solubles en disolventes orgánicos e insolubles en el agua. Sus estados físicos varían con el número de carbonos que componen el compuesto. A mayor peso molecular mayor son los puntos de ebullición y fusión, así como la densidad.
Nomenclatura Química Soluciones preparación y valoración Propiedades Coligativas Equilibrio Químico Equilibrio Ionico Estructura y propiedades de los compuestos químicos orgánicos Propiedades físicas y químicas de los hidrocarburos Propiedades Alcoholes Propiedades Feroles Propiedades Aminas Propiedades Aldehidos Cetona Propiedades Acidos Carboxilicos Derivados Halogenados Nomenclatura de los compuestos orgánicos Electroquímica Oxido - Reducción Cambios de Fase Energía Calorifica Enlace Químico Isometría
Propiedades físicas y químicas de los hidrocarburos Los hidrocarburos son compuestos orgánicos formados exclusivamente por carbono e hidrógeno.
Los hidrocarburos se clasifican en: Hidrocarburos saturados, llamados también alcanos, que presentan enlaces sencillos. Los alquenos, que tienen enlaces dobles Alcanos: Los átomos de carbono de un alcano pueden ser clasificados como: átomo primario cuando se unen a un carbono, secundario, si se unen a dos carbonos, terciario, si se unen a tres o cuaternario si se unen a cuatro.
LOS ALCANOS Punto de ebullición: el punto de ebullición aumenta con el tamaño del alcano porque las fuerzas intermoleculares (fuerzas de Van der Waals y de London), son más efectivas cuando la molécula presenta mayor superficie. Es así, que los puntos de fusión y ebullición van a aumentar a medida que se incrementa el número de átomos de carbono.
Los alcanos que se presentan a la izquierda, tienen el mismo número de carbonos pero sus puntos de ebullición son distintos. Esto se debe a que la superficie efectiva de o entre dos moléculas disminuye cuanto más ramificadas sean éstas. Las fuerzas intermoleculares son menores en los alcanos ramificados por ello tienen puntos de ebullición más bajos. Isomeros C5H12 Puntos de ebullición
Punto de Fusión Punto de fusión: El punto de fusión también aumenta con el tamaño del alcano por la misma razón que aumenta el punto de ebullición. Los alcanos con número impar de carbonos se empaquetan en una estructura cristalina y poseen puntos de ebullición un poco menores de lo esperados en los pares. Densidad: a medida que aumenta el número de carbonos, las fuerzas intermoleculares son mayores y por lo tanto la cohesión intermolecular. Esto da como resultando un aumento de la proximidad molecular y, por tanto, de la densidad.
Densidad del estado liquido Solubilidad: Los alcanos por ser compuestos apolares no se disuelven en agua, sino en solventes no polares como el benceno, éter y cloroformo. A temperatura ambiente es posible encontrar alcanos en diferentes estados físicos así: De metano a butano son gaseosos. De pentano a hexadecano son líquidos De heptadecano en adelante son sólidos.
Propiedades químicas de los alquinos: los alquinos terminales se comportan como ácidos porque, en presencia de bases fuertes, pueden ceder un protón. Alcanos: Los átomos de carbono de un alcano pueden ser clasificados como: átomo primario cuando se unen a un carbono, secundario, si se unen a dos carbonos, terciario, si se unen a tres o cuaternario si se unen a cuatro.
LOS ALQUINOS Como podría esperarse,las propiedades físicas de los alquinos son muy similares a las de los alquenos y los alcanos.Los alquinos son ligeramente solubles en agua aunque son algo más solubles que los alquenos y los alcanos.A semejanza de los alquenos y alcanos, los alquinos son solubles en disolventes de baja polaridad,como tetracloruro de carbono,éter y alcanos.Los alquinos, al igual que los alquenos y los alcanos son menos densos que el agua. Los tres primeros alquinos son gases a temperatura ambiente. Los alquinos tienen unas propiedades físicas similares a los alcanos y alquenos. Son poco solubles en agua, tienen una baja densidad y presentan bajos puntos de ebullición. Sin embargo, los alquinos son más polares debido a la mayor atracción que ejerce un carbono sp sobre los electrones, comparado con un carbono sp3 o sp2.