Sci Chi Mico 635w6g
This document was ed by and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this report form. Report 3b7i
Overview 3e4r5l
& View Sci Chi Mico as PDF for free.
More details w3441
- Words: 1,305
- Pages: 19
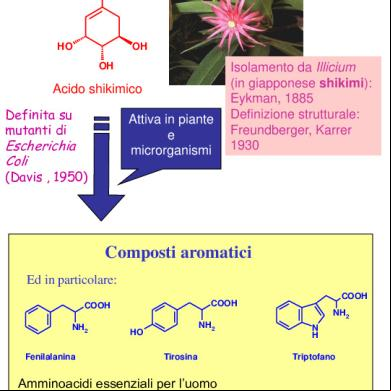
Via dello shikimato COOH
HO
OH OH
Acido shikimico Definita su mutanti di
Attiva in piante e microrganismi
Escherichia Coli
Isolamento da Illicium (in giapponese shikimi): Eykman, 1885 Definizione strutturale: Freundberger, Karrer 1930
(Davis , 1950)
Composti aromatici Ed in particolare:
NH2 Fenilalanina
COOH
COOH
COOH
NH2 NH2
HO Tirosina
Amminoacidi essenziali per l’uomo
N H Triptofano
La via biogenetica ciclo del pentoso fosfato
GLUCOSIO glicolisi
CHO
CO2H
OH
H2C
C
OH
OP
Fosfoenolpiruvato (PEP)
CH2OP D-eritrosio-4-fosfato COOH
HO
OH
OH Acido Shikimico
COOH
HO
O OH
CH2
C
COOH
Acido Corismico HOOC Acido Protocatechico; Acido Salicilico Acido Gallico Acido p-Idrossibenzoico; Acido p-Amminobenzoico; Acido Antranilico
Triptofano
CH2COOH
OH Acido Prefenico
Fenilalanina; Tirosina
Biosintesi dell’acido shikimico
CO2H P
O
PO
PO
H
OH
H+ O
NAD+ HO
OH
CO2H
CO2H
O
OH
O
OH
OH
OH Acido shikimico
OH
Acido 3-deidroshikimico -H2O
Acido 3-deidrochinico
-H2
CO2H
HO
HO
CO2H
CO2H
-H2O
NADPH OH
HO
OH OH
OH Acido D-Arabino-eptulosonico-7-P
D-Eritrosio-4-P
HO
-HOP
O
H HO
O
HO
CO2H
CO2H
PEP
CO2H
HO OH
Acido protocatechico
OH OH
Acido gallico
HO
OH OH
Acido chinico
Dall’acido shikimico all’acido corismico CO2H
EPSP :acido 5-enolpiruvil shikimico 3-fosfato
CO2H
CO2H
P
O PEP
ATP
CO2H
H+
H2 C H
EPSP sintasi OH
HO
OH
PO
OH
PO
OH
Acido Shikimico
O CO2H OP
OH
Acido Shikimico-3P
-HOP
Dal greco cwrizw dividere
CO2H CO2H H -HOP
O
CO2H PO
OH Acido Corismico
CO2H
OH Acido 5-enolpiruvil shikimico-3-fosfato
C
A
O
B CO2H
CO2H HO2C
CH2COCO2H
CO2H
OH OH
OH Acido protocatechico CO2H
NH2 OH
HO
Acido p-idrossibenzoico
OH Acido Prefenico
NH2 Acido p-amminobenzoico
NH2
CO2H
CO2H
CO2H
CO2H NH2
OH
Acido antranilico
Acido salicilico
OH Acido gallico Fenilalanina OH Tirosina
La via biosintetica C: acidi o/p idrossi-, amminobenzoici. CO2 H
CO2 H
CO2 H
CO2 H
OH2
OH
OH
-PEP
-PEP O
O OH H+
Acido 4-Idrossibenzoico CO2 H
OH
Acido Corismico NH3
Acido Isocorismico
CO2 H NH2
CO2 H
O
-PEP CO2 H
CO2 H
Acido 2-ammino2-deossiisocorismico -PEP CO2 H NH2
NH2
Acido p-Amminobenzoico (PABA)
Acido Folico
Acido Antralinico
Triptofano
CO2 H OH
NH2
Acido 4-ammino4-deossicorismico
Acido Salicilico
NH3 CO2 H
O
CO2 H
CO2 H
OH
NAD+
OH
OH
Acido 2,3 diidrossibenzoico
Biosintesi del triptofano CO2H
CO2H
CO2H OH
OH
H NH
NH2 Acido antranilico
HO
O OH H+ Acido fosforibosil antranilico
O OH
fosforibosil PP
H O
OH
+ N H
CH2OP
HO
CH2OP PPO
OP
O
OH
OH
CO2H HO
O
OP
OP OH
OH
N H
N H -CO2 OP
HO
OP
HO -H2O
HO OH
OH
N H
N H
indol-3-glicerolo P
CO2 H
HO
OP
O
NH2 L-Ser
OH H gliceraldeide-3-P
CO2H NH2 N H L-Trp
Metabolismo del triptofano CH2COOH
NH2
HO N H
N H Acido Indolacetico (auxina)
Serotonina
NH2 N H Triptammina
NH2 COOH
Alcaloidi N H Triptofano
NH2 COOH O NHCH=O N-Formilchinurenina NH2 COOH O NH2 Chinurenina
Metabolismo ossidativo della chinurenina: Gli ommocromi i pigmenti degli occhi degli artropodi
NH2
NH2
COOH
COOH
O
O O
NH2
NH2 OH 3-Idrossichinurenina
Chinurenina
O H2N
COOH O
H2N HO
COOH
COOH O
HO
COOH
N
N
H N
N
O
O
O
O-G
Xanthommatina
Rhodommatina
Butenadt, A., Beckmann, R. Ommochromes. VI. Genesis of rhodommatin and ommatin C. Hoppe Seylers Z Physiol Chem. 1955, 301, 115-117
La via biosintetica A: l’acido gallico ed i tannini OH OH
O
O
COOH
HO HO OH
O
HO
Acido Gallico
O
OH Acido Ellagico
I tannini sono in grado di legarsi stabilmente alle proteine (es. cheratina) ed anche ad altri biopolimeri come cellulosa e pectina fungendo da cross linkers e modificandone quindi le proprietà meccaniche e chimiche. In ato i tannini erano impiegati per la concia delle pelli.
ROCH2 O OR RO
OR O C=O OH
HO
OOC
OH
OH
OH OH
OOC Gallotannino
OH
I tannini si suddividono in: Tannini non idrolizzabili: la cui struttura è ancora poco nota; Tannini idrolizzabili: esteri dell’acido gallico, di acidi poligallici e di altri dimeri derivanti dall’acido gallico (es acido ellagico) con il glucosio.
Metabolismo ossidativo del pirogallolo: la PURPUROGALLINA HO
HO -2H+, -2e-
HO
O
OH
O
HO O
O
Pirogallolo H2O HO
HO
O O
O
O O-
O
O
O HO
O
COOH HO
-2H+, -2e-
HO
HO
-CO2
HO
OH
OH
OH
OH
O
OH
Purpurogallina
La via biosintetica B: dall’acido corismico a Phe e Tyr via acido prefenico. COOH
HOOC CH2
O OH
CH2COCOOH
Trasposizione di Claisen
COOH
Corismato mutasi OH
H+ Acido Prefenico
Acido Corismico -H2O -CO2 O
O a HOOC
CH2COCOOH
COOH
O Acido Fenilpiruvico Transaminazione
PLP
-CO2 O COOH
NH2 COOH
Fenilalanina
OH Acido p-Idrossifenilpiruvico Transaminazione
PLP NH2 COOH
OH Tirosina
Metabolismo Phe e Tyr in piante e microorganismi COOH
COOH
PAL
PAL (TAL): Phenylalanine (Tyrosine) Ammonia Lyase Acido Cinnammico
-NH3
NH2 Fenilalanina
Citocromo P450 O2, NADPH COOH NH2
HO
COOH
TAL -NH3
(solo graminacee)
Tirosina
O
HO
CH2OH HO Alcol p-Cumarilico
Acido p-Cumarico O COOH
HO HO Acido Caffeico SAM
CH3 COOH
CH3O HO
HO Alcol Coniferilico
Acido Ferulico SAM
CH2OH
CH3O
O
CH3 COOH
CH3O HO
CH2OH
CH3O HO
OMe Acido Sinapico
OMe Alcol Sinapilico
Metabolismo acidi cinnamici
Precursori e metaboliti delle lignine O
CH3O
CH2OH
HO
CH2OH
OH
CH3O OMe
O
HO
OMe OH Isolariciresinolo
Antimitotico, antitumorale
Pinoresinolo
OH H
O
O
HO
O
O
O
H
MeO
O
OMe OH
OMe
Podofillotossina
Enterolattone
Nelle radici del podofillo Un fitoestrogeno prodotto dalla microflora intestinale. Protegge da tumori indotti da ormoni e da malattie cardiovascolari
Biosintesi di lignani e lignine OH
OH
OH
.
-H+ -e-
MeO
MeO OH
x2
MeO
.O
O
x2
Alcol Coniferilico O OMe
CH3O
CH2OH
O
CH2OH
CH3O O
OH
HO
OMe
CH3O
CH2OH
HO
CH2OH
O
OMe
OH O
OMe
H O
O
CH3O
CH2OH
HO
CH2OH
H OMe OMe
OH
OH (+)-Pinoresinolo
(+) -Isolariciresinolo
Metabolismo acidi cinnamici
Le cumarine COOH
COOH
O HO
Acido Cinnammico
Acido p-Cumarico O
O COOH
COOH HO
OH
OH
Acido o-Cumarico Glucosilazione
Glucosilazione
COOH
COOH HO
OG Isomerizzazione cis-trans
COOH OG
Isomerizzazione cis-trans
HO
Idrolisi 5
OG
COOH OG Idrolisi
4
6
3 2
7 8
O 1
HO
O
O
O
Umbelliferone
Cumarina
Sbiancanti ottici in detergenti, tessuti, carta, plastica, pitture
Filtro solare
O HO HO
O Esculetina
O
Il dicumarolo: un potente anticoagulante Causa di emorragie mortali in animali alimentati con Melitotus officinalis
OH
OH
O
O O
O Dicumarolo
Meccanismo di formazione del dicumarolo Unità "C1" da processi di fermentazione
H+
O OH H
O
OH
OH
O
O
H
O
-H2O
4-idrossicumarina H+
O
OH
O
O
O OH
OH
O
O
O O
O
Oggi usato come anticoagulante del sangue per il trattamento delle trombosi. Analoghi sintetici come la warfarina usati come rodenticidi.
OH
O
O
Gli psoraleni 1. La biosintesi OPP +
DMAPP
.. HO
O
O
O
HO
umbelliferone
O
demetilsuberosina O2 NADPH
HO
O2 NADPH
HO
HO O
O
O
O
O
O
marmesina
-CH3COCH3 O2 NADPH O
O
O
O
O
OH
psoralene O2 NADPH
xantossolo SAM
OH
O
O
O
bergaptolo
O
O
O
OMe
SAM
xantossina (8-metossipsoralene)
OMe
O
O
O
O
bergaptene (5-metossipsoralene)
Gli psoraleni 2. Le proprietà biologiche Si intercalano al DNA formando addotti O
O HN O
O O
N
O
h
O
HN
OMe cicloaddizione fotoindotta
O
O
N
O
OMe
8-MOP addotto psoralene-DNA O H h N N O
Timina nel DNA
La duplicazione del DNA è inibita, la velocità della divisione cellulare è ridotta
O
O O
HN O
Effetti tossici nella manipolazione di piante
N
O
OMe
di-addotto psoralene-DNA
ricche di psoraleni
Ruta graveolens
Heracleum mantegazzianum (pacace gigante)
Gli psoraleni 3. Le proprietà farmacologiche e cosmetiche Promuovono la pigmentazione cutanea e l’abbronzatura. L’olio di bergamotto è usato come abbronzante.
Utilizzati anche per il trattamento della vitiligine e psoriasi Terapia PUVA : somministrazione orale 8-metossipsoralene seguita da irradiazione con luce UV-A
HO
OH OH
Acido shikimico Definita su mutanti di
Attiva in piante e microrganismi
Escherichia Coli
Isolamento da Illicium (in giapponese shikimi): Eykman, 1885 Definizione strutturale: Freundberger, Karrer 1930
(Davis , 1950)
Composti aromatici Ed in particolare:
NH2 Fenilalanina
COOH
COOH
COOH
NH2 NH2
HO Tirosina
Amminoacidi essenziali per l’uomo
N H Triptofano
La via biogenetica ciclo del pentoso fosfato
GLUCOSIO glicolisi
CHO
CO2H
OH
H2C
C
OH
OP
Fosfoenolpiruvato (PEP)
CH2OP D-eritrosio-4-fosfato COOH
HO
OH
OH Acido Shikimico
COOH
HO
O OH
CH2
C
COOH
Acido Corismico HOOC Acido Protocatechico; Acido Salicilico Acido Gallico Acido p-Idrossibenzoico; Acido p-Amminobenzoico; Acido Antranilico
Triptofano
CH2COOH
OH Acido Prefenico
Fenilalanina; Tirosina
Biosintesi dell’acido shikimico
CO2H P
O
PO
PO
H
OH
H+ O
NAD+ HO
OH
CO2H
CO2H
O
OH
O
OH
OH
OH Acido shikimico
OH
Acido 3-deidroshikimico -H2O
Acido 3-deidrochinico
-H2
CO2H
HO
HO
CO2H
CO2H
-H2O
NADPH OH
HO
OH OH
OH Acido D-Arabino-eptulosonico-7-P
D-Eritrosio-4-P
HO
-HOP
O
H HO
O
HO
CO2H
CO2H
PEP
CO2H
HO OH
Acido protocatechico
OH OH
Acido gallico
HO
OH OH
Acido chinico
Dall’acido shikimico all’acido corismico CO2H
EPSP :acido 5-enolpiruvil shikimico 3-fosfato
CO2H
CO2H
P
O PEP
ATP
CO2H
H+
H2 C H
EPSP sintasi OH
HO
OH
PO
OH
PO
OH
Acido Shikimico
O CO2H OP
OH
Acido Shikimico-3P
-HOP
Dal greco cwrizw dividere
CO2H CO2H H -HOP
O
CO2H PO
OH Acido Corismico
CO2H
OH Acido 5-enolpiruvil shikimico-3-fosfato
C
A
O
B CO2H
CO2H HO2C
CH2COCO2H
CO2H
OH OH
OH Acido protocatechico CO2H
NH2 OH
HO
Acido p-idrossibenzoico
OH Acido Prefenico
NH2 Acido p-amminobenzoico
NH2
CO2H
CO2H
CO2H
CO2H NH2
OH
Acido antranilico
Acido salicilico
OH Acido gallico Fenilalanina OH Tirosina
La via biosintetica C: acidi o/p idrossi-, amminobenzoici. CO2 H
CO2 H
CO2 H
CO2 H
OH2
OH
OH
-PEP
-PEP O
O OH H+
Acido 4-Idrossibenzoico CO2 H
OH
Acido Corismico NH3
Acido Isocorismico
CO2 H NH2
CO2 H
O
-PEP CO2 H
CO2 H
Acido 2-ammino2-deossiisocorismico -PEP CO2 H NH2
NH2
Acido p-Amminobenzoico (PABA)
Acido Folico
Acido Antralinico
Triptofano
CO2 H OH
NH2
Acido 4-ammino4-deossicorismico
Acido Salicilico
NH3 CO2 H
O
CO2 H
CO2 H
OH
NAD+
OH
OH
Acido 2,3 diidrossibenzoico
Biosintesi del triptofano CO2H
CO2H
CO2H OH
OH
H NH
NH2 Acido antranilico
HO
O OH H+ Acido fosforibosil antranilico
O OH
fosforibosil PP
H O
OH
+ N H
CH2OP
HO
CH2OP PPO
OP
O
OH
OH
CO2H HO
O
OP
OP OH
OH
N H
N H -CO2 OP
HO
OP
HO -H2O
HO OH
OH
N H
N H
indol-3-glicerolo P
CO2 H
HO
OP
O
NH2 L-Ser
OH H gliceraldeide-3-P
CO2H NH2 N H L-Trp
Metabolismo del triptofano CH2COOH
NH2
HO N H
N H Acido Indolacetico (auxina)
Serotonina
NH2 N H Triptammina
NH2 COOH
Alcaloidi N H Triptofano
NH2 COOH O NHCH=O N-Formilchinurenina NH2 COOH O NH2 Chinurenina
Metabolismo ossidativo della chinurenina: Gli ommocromi i pigmenti degli occhi degli artropodi
NH2
NH2
COOH
COOH
O
O O
NH2
NH2 OH 3-Idrossichinurenina
Chinurenina
O H2N
COOH O
H2N HO
COOH
COOH O
HO
COOH
N
N
H N
N
O
O
O
O-G
Xanthommatina
Rhodommatina
Butenadt, A., Beckmann, R. Ommochromes. VI. Genesis of rhodommatin and ommatin C. Hoppe Seylers Z Physiol Chem. 1955, 301, 115-117
La via biosintetica A: l’acido gallico ed i tannini OH OH
O
O
COOH
HO HO OH
O
HO
Acido Gallico
O
OH Acido Ellagico
I tannini sono in grado di legarsi stabilmente alle proteine (es. cheratina) ed anche ad altri biopolimeri come cellulosa e pectina fungendo da cross linkers e modificandone quindi le proprietà meccaniche e chimiche. In ato i tannini erano impiegati per la concia delle pelli.
ROCH2 O OR RO
OR O C=O OH
HO
OOC
OH
OH
OH OH
OOC Gallotannino
OH
I tannini si suddividono in: Tannini non idrolizzabili: la cui struttura è ancora poco nota; Tannini idrolizzabili: esteri dell’acido gallico, di acidi poligallici e di altri dimeri derivanti dall’acido gallico (es acido ellagico) con il glucosio.
Metabolismo ossidativo del pirogallolo: la PURPUROGALLINA HO
HO -2H+, -2e-
HO
O
OH
O
HO O
O
Pirogallolo H2O HO
HO
O O
O
O O-
O
O
O HO
O
COOH HO
-2H+, -2e-
HO
HO
-CO2
HO
OH
OH
OH
OH
O
OH
Purpurogallina
La via biosintetica B: dall’acido corismico a Phe e Tyr via acido prefenico. COOH
HOOC CH2
O OH
CH2COCOOH
Trasposizione di Claisen
COOH
Corismato mutasi OH
H+ Acido Prefenico
Acido Corismico -H2O -CO2 O
O a HOOC
CH2COCOOH
COOH
O Acido Fenilpiruvico Transaminazione
PLP
-CO2 O COOH
NH2 COOH
Fenilalanina
OH Acido p-Idrossifenilpiruvico Transaminazione
PLP NH2 COOH
OH Tirosina
Metabolismo Phe e Tyr in piante e microorganismi COOH
COOH
PAL
PAL (TAL): Phenylalanine (Tyrosine) Ammonia Lyase Acido Cinnammico
-NH3
NH2 Fenilalanina
Citocromo P450 O2, NADPH COOH NH2
HO
COOH
TAL -NH3
(solo graminacee)
Tirosina
O
HO
CH2OH HO Alcol p-Cumarilico
Acido p-Cumarico O COOH
HO HO Acido Caffeico SAM
CH3 COOH
CH3O HO
HO Alcol Coniferilico
Acido Ferulico SAM
CH2OH
CH3O
O
CH3 COOH
CH3O HO
CH2OH
CH3O HO
OMe Acido Sinapico
OMe Alcol Sinapilico
Metabolismo acidi cinnamici
Precursori e metaboliti delle lignine O
CH3O
CH2OH
HO
CH2OH
OH
CH3O OMe
O
HO
OMe OH Isolariciresinolo
Antimitotico, antitumorale
Pinoresinolo
OH H
O
O
HO
O
O
O
H
MeO
O
OMe OH
OMe
Podofillotossina
Enterolattone
Nelle radici del podofillo Un fitoestrogeno prodotto dalla microflora intestinale. Protegge da tumori indotti da ormoni e da malattie cardiovascolari
Biosintesi di lignani e lignine OH
OH
OH
.
-H+ -e-
MeO
MeO OH
x2
MeO
.O
O
x2
Alcol Coniferilico O OMe
CH3O
CH2OH
O
CH2OH
CH3O O
OH
HO
OMe
CH3O
CH2OH
HO
CH2OH
O
OMe
OH O
OMe
H O
O
CH3O
CH2OH
HO
CH2OH
H OMe OMe
OH
OH (+)-Pinoresinolo
(+) -Isolariciresinolo
Metabolismo acidi cinnamici
Le cumarine COOH
COOH
O HO
Acido Cinnammico
Acido p-Cumarico O
O COOH
COOH HO
OH
OH
Acido o-Cumarico Glucosilazione
Glucosilazione
COOH
COOH HO
OG Isomerizzazione cis-trans
COOH OG
Isomerizzazione cis-trans
HO
Idrolisi 5
OG
COOH OG Idrolisi
4
6
3 2
7 8
O 1
HO
O
O
O
Umbelliferone
Cumarina
Sbiancanti ottici in detergenti, tessuti, carta, plastica, pitture
Filtro solare
O HO HO
O Esculetina
O
Il dicumarolo: un potente anticoagulante Causa di emorragie mortali in animali alimentati con Melitotus officinalis
OH
OH
O
O O
O Dicumarolo
Meccanismo di formazione del dicumarolo Unità "C1" da processi di fermentazione
H+
O OH H
O
OH
OH
O
O
H
O
-H2O
4-idrossicumarina H+
O
OH
O
O
O OH
OH
O
O
O O
O
Oggi usato come anticoagulante del sangue per il trattamento delle trombosi. Analoghi sintetici come la warfarina usati come rodenticidi.
OH
O
O
Gli psoraleni 1. La biosintesi OPP +
DMAPP
.. HO
O
O
O
HO
umbelliferone
O
demetilsuberosina O2 NADPH
HO
O2 NADPH
HO
HO O
O
O
O
O
O
marmesina
-CH3COCH3 O2 NADPH O
O
O
O
O
OH
psoralene O2 NADPH
xantossolo SAM
OH
O
O
O
bergaptolo
O
O
O
OMe
SAM
xantossina (8-metossipsoralene)
OMe
O
O
O
O
bergaptene (5-metossipsoralene)
Gli psoraleni 2. Le proprietà biologiche Si intercalano al DNA formando addotti O
O HN O
O O
N
O
h
O
HN
OMe cicloaddizione fotoindotta
O
O
N
O
OMe
8-MOP addotto psoralene-DNA O H h N N O
Timina nel DNA
La duplicazione del DNA è inibita, la velocità della divisione cellulare è ridotta
O
O O
HN O
Effetti tossici nella manipolazione di piante
N
O
OMe
di-addotto psoralene-DNA
ricche di psoraleni
Ruta graveolens
Heracleum mantegazzianum (pacace gigante)
Gli psoraleni 3. Le proprietà farmacologiche e cosmetiche Promuovono la pigmentazione cutanea e l’abbronzatura. L’olio di bergamotto è usato come abbronzante.
Utilizzati anche per il trattamento della vitiligine e psoriasi Terapia PUVA : somministrazione orale 8-metossipsoralene seguita da irradiazione con luce UV-A