Termo Capacidad Calorifica 05 1t2q5s
This document was ed by and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this report form. Report 3b7i
Overview 3e4r5l
& View Termo Capacidad Calorifica 05 as PDF for free.
More details w3441
- Words: 2,775
- Pages: 10
1
Capacidad Calorífica
Desde el punto de vista termodinámico, calor es una forma de energía que aparece en un proceso y cuyo origen no es mecánico. El Calor es, pues, una forma de energía en tránsito, es decir, es la forma bajo la cual se transfiere la energía calórica desde un cuerpo a otro por conducción, radiación, o convección. No solamente los cambios físicos y químicos pueden originar absorción de calor de un sistema, sino también el simple aumento de temperatura. El hecho de que dos o más sustancias tengan la misma temperatura no significa que sean térmicamente idénticas. Es un hecho experimental que masas iguales de sustancias distintas pueden requerir cantidades diferentes de calor para aumentar sus temperaturas en la misma cantidad. Para una transferencia infinitesimal de calor el aumento en la temperatura es proporcional al calor suministrado, es decir:
dQ ∼ dT
dQ = C ⋅ dT En otras palabras, decimos que cuando una cantidad de calor ∆Q se transfiere desde el sistema de mayor temperatura al sistema de menor temperatura: •
La cantidad de calor transferida es proporcional al cambio de temperatura ∆T , esto es: ∆Q ∼ ∆T
•
La constante de proporcionalidad C se denomina Capacidad Calorífica del sistema: ∆Q = C ⋅ ∆T
Donde C es el coeficiente de proporcionalidad, es decir, una constante y se llama la Capacidad Calorífica C del sistema. Una sustancia con una capacidad calorífica alta requerirá una mayor transferencia de calor para elevar su temperatura que una sustancia con una capacidad calorífica menor, para una masa dada. La Capacidad Calorífica C se puede expresar como el cuociente entre el calor absorbido ( dQ ) y la variación de temperatura ( dT ):
C=
dQ dT
Por consiguiente, la Capacidad Calorífica C de una sustancia es la cantidad de calor necesaria para elevar su temperatura en un grado (Celsius o Kelvin).
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
2
Por regla general, el calor se expresa en función de una unidad denominada caloría que se define como la cantidad de calor necesaria para elevar en 1 grado la temperatura de 1 gramo de agua de 15,5 a 16,5°C. De esta definición de caloría, resulta evidente que la capacidad calorífica de 1 gramo de agua, en la proximidad de los 15°C es igual a 1 caloría. Pero según Joule, esa cantidad de calor es equivalente a un trabajo mecánico de 4,184 J. Entonces, una caloría es igual a 4.184 J y el factor de conversión de unas unidades a otras se conoce como el equivalente mecánico del calor, a menudo representado por J. Así: J = 4,184 joule/cal En las unidades del Systems International (SI), la Capacidad Calorífica de un sistema es la cantidad de joules necesario para elevar la temperatura de un cuerpo en 1°K. La capacidad calorífica depende de: • la masa del cuerpo • de su composición química • de su estado termodinámico, y • del tipo de transformación durante la cual se le cede calor. La capacidad calorífica es una propiedad que es proporcional a la cantidad de sustancia presente y, por consiguiente, ésta se debe especificar: Calor Específico (c). Es la cantidad de calor necesaria que hay que suministrar a 1 gramo de una sustancia para que incremente su temperatura en 1 grado. El calor específico corresponde a la capacidad calorífica por unidad de masa (c = C/m). Capacidad Calorífica Molar: Es la cantidad de calor necesaria expresada en calorías, para aumentar en 1°C un mol de una sustancia. De acuerdo a las definiciones anteriores, se aprecia que la capacidad calorífica molar resulta del producto del calor específico por el peso molecular de una sustancia (gramo/mol). La fórmula para la transferencia de calor entre los cuerpos se expresa en términos de la masa m , del calor específico c y del cambio de temperatura ( ∆T ): ∆Q = mc∆T
∆Q = mc(T final − Tinicial ) Por tanto, la cantidad de calor liberado o absorbido por una sustancia es proporcional a su masa y a la variación de temperatura que experimenta y, además, depende de la naturaleza del material.
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
3
Las unidades en que normalmente se expresa la capacidad calorífica son joule caloría o . Por consiguiente resulta más mol ⋅ grado mol ⋅ grado conveniente emplear la capacidad calorífica molar que el calor específico. Debemos recordar que cada forma de energía se puede expresar como el producto de un factor de intensidad (propiedad intensiva) por un factor de capacidad (propiedad extensiva). De estas relaciones, tenemos que el cambio en el contenido calórico ( dQ ) experimentado por un mol de un sistema de calor específico molar C (propiedad extensiva) correspondiente a un cambio en la temperatura ( dT ) (propiedad intensiva) viene dado por: dQ = C ⋅ dT Puesto que la Capacidad Calorífica C es la cantidad de calor necesaria para producir una variación de temperatura de un grado, es evidente que el calor que se requiere para producir una variación de temperatura ∆T es: Q = C ⋅ ∆T = C ⋅ (T2 − T1 )
Dicho en otras palabras, la Capacidad Calorífica C de un cuerpo es la propiedad que, multiplicada por la variación de temperatura, da la cantidad de energía que ha tomado o cedido el cuerpo como calor cuando se pone en o con otro que tiene una temperatura diferente. Por lo tanto, si la temperatura del cuerpo sube de T1 a T2 al tomar una cantidad de calor Q , entonces la capacidad calorífica C del cuerpo viene dado por:
C=
Q Q = T2 − T1 ∆T
Sin embargo, hay una dificultad inmediata para poder aplicar esta ecuación, debido a que el calor no es una función de estado. Por consiguiente, el calor que interviene en un proceso está determinado, no solamente por los estados inicial y final, sino también por la forma en que se realiza el proceso. En esta ecuación nada se dice acerca de cómo varía la temperatura. Esta dificultad se puede evitar definiendo dos capacidades caloríficas molares: 1) Capacidad Calorífica para procesos a presión constante, , y 2) Capacidad Calorífica para procesos a volumen constante, Cv . Estas definiciones, en forma infinitesimal, son:
=
dQP dT
y
CV =
dQV dT
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
4
A partir de estas definiciones, el calor necesario para variar la temperatura de n moles de una sustancia desde T1 a T2 es:
QP =
T2
∫
n dT
Para un proceso a Presión Constante.
T1
T2
QV = ∫ nCV dT
Para un proceso a Volumen Constante.
T1
Para muchas sustancias en las proximidades de la temperatura ambiente, y Cv son constantes e independiente. En estas condiciones las dos ecuaciones anteriores se pueden integrar fácilmente para obtener: QP = n ⋅ ⋅ (T2 − T1 )
QV = n ⋅ CV ⋅ (T2 − T1 ) La capacidad calorífica a volumen constante generalmente es menor que a presión constante. La diferencia se debe que un sistema a presión constante puede expandirse por calentamiento, usando algo de calor transferido en hacer trabajo sobre los alrededores, mientras que a volumen constante toda la energía transferida produce un aumento en la temperatura. Relación entre C P y C V y las Funciones de Estado H y U , respectivamente De acuerdo con la Primera Ley: dU = dQrev − dWrev dQrev = dU + dWrev Pero: c =
dQrev dT
dQrev = cdT Por tanto:
cdT = dU + dWrev c =
(dU + dWrev ) dT
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
5
La capacidad calorífica definida así es claramente dependiente del tipo de proceso que se utilice para suministrar calor. Si el sistema realiza trabajo dWrev (es decir, PdV) la ecuación anterior se transforma en:
c =
(dU + PdV ) dT
(Ec. a)
Si durante el proceso de adición del calor, el volumen V se mantiene constante ( dV = 0 ) entonces la capacidad calorífica que se obtiene es aquella a volumen constante cv , donde:
⎛ dU ⎞ cv = ⎜ ⎟ ⎝ dT ⎠ Por consiguiente, para un proceso a volumen constante: ∆U = ∫ cv dT
Por otra parte, si usamos un proceso a presión constante para ceder el calor, y utilizamos la ecuación, notando que: H = U + PV
Diferenciando: pero dP = 0 ( P = cons tan te )
dH = dU + PdV + VdP
dU = dH − PdV
Obtendremos que la Ec. a se transforma en ese caso en:
=
(dH − PdV + PdV ) dT
⎛ dH ⎞ = ⎜ ⎟ ⎝ dT ⎠ Por consiguiente, para un proceso a presión constante:
∆Η = ∫ dT
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
6
Capacidad Calorífica para Gas Ideal Para un gas ideal la relación entre C P y C V es muy sencilla:
C P =C V + R Para demostrar esta relación basta combinar la ecuación de definición de entalpía con las definiciones de C P y C V : H = U + PV
Diferenciando con respecto a T:
dH dU d (PV ) = + dT dT dT C P = CV +
d (PV ) dT
Pero
PV = nRT
para n = 1
C P = CV +
por consiguiente:
C P = CV + R
d (RT ) dT
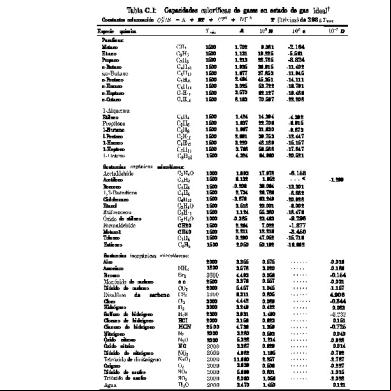
Para Problemas Geológicos Para los efectos de cálculo de problemas geológicos, la capacidad calorífica que usaremos es la que corresponde a un proceso a presión constante, es decir, c p . En este caso ∆c p , es decir, el cambio de capacidad calorífica en una reacción química entre productos y reactantes, puede asumir las siguientes situaciones:
•
∆c p = 0 , es decir la capacidad calorífica es independiente de la temperatura.
•
∆c p = constante, es decir, la capacidad calorífica no varía entre el intervalo de temperatura que interesa desarrollar la reacción química.
•
∆c p = función de la temperatura, es decir, debe utilizarse una ecuación que expresa la dependencia de C p con la
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
7
temperatura, a objeto de poder desarrollar la integral entre los intervalos de temperatura de interés. Así, las ecuaciones empíricas para evaluar C p pueden tomar distintas formas, por ejemplo:
= a + 2bT − cT −2 = a + bT + cT −2 = a + bT + cT 2 La ecuación empírica más utilizada es la de Maier-Kelley: c p = a + bT + cT −2
=
∫ (a + bT + cT )dT
T2
−2
T1
C p = a (T2 − T1 ) +
⎛1 b 2 1 ⎞ ⎟⎟ T2 − T12 − c⎜⎜ − 2 ⎝ T2 T1 ⎠
(
)
Efecto Joule-Thomson. En Física, el efecto de Joule-Thomson, es el proceso en el cual la temperatura de un sistema disminuye o aumenta al permitir que el sistema se expanda libremente manteniendo la entalpía constante. La relación entre temperatura, presión y volumen de un gas se puede describir de una forma sencilla gracias a las leyes de los gases. Cuando el volumen aumenta durante un proceso irreversible, las leyes de los gases no pueden determinar por si solas qué ocurre con la temperatura y presión del gas. En general, cuando un gas se expande adiabáticamente, la temperatura puede aumentar o disminuir, dependiendo de la presión y temperatura inicial. Para una presión constante (fijada previamente), un gas tendrá una temperatura de inversión de Joule-Thomson, sobre la cual al expandirse el gas causa un aumento de temperatura, y por debajo, la expansión del gas causa un enfriamiento. En la mayoría de los gases, a presión atmosférica esta temperatura es bastante alta, mucho mayor que la temperatura ambiental, y por ello la mayoría de los gases se enfrían al expandirse. El incremento de temperatura (∆T) con respecto al incremento de presión (∆p) en un proceso de Joule-Thomson es el coeficiente de Joule-Thomson (µ JT ) :
µ JT =
∆T ∆P
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
8
⎛ dT ⎞ Esta expresión se puede encontrar también escrita como µ JT = ⎜ ⎟ ⎝ dP ⎠ H
El valor de µJT depende del gas específico, tanto como la temperatura y la presión del gas antes de la expansión o compresión. Para gases reales esto será igual a cero en un mismo punto llamado punto de inversión y la temperatura de inversión Joule-Thomson es aquella donde el signo del coeficiente cambia.
Cambios de Estado Normalmente, una sustancia experimenta un cambio de temperatura cuando absorbe o cede calor al ambiente que le rodea. Sin embargo, cuando una sustancia cambia de estado o fase, tal como la vaporización de un líquido, la fusión o sublimación de un sólido, y la transición polimórfica de una estructura cristalina a otra, va acompañada de una absorción o liberación de calor sin que se produzca un cambio de su temperatura. El calor Q que es necesario aportar para que una masa m de cierta sustancia cambie de fase es igual a:
Q = mL donde L se denomina calor latente de la sustancia y depende del tipo de cambio de fase. Por ejemplo, para que el agua cambie de sólido (hielo) a líquido, a 0ºC se necesitan 334·103 J/kg. Para que cambie de líquido a vapor a 100 ºC se precisan 2260·103 J/kg. Los cambios de estado se pueden explicar de forma cualitativa del siguiente modo: En un sólido los átomos y moléculas ocupan las posiciones fijas de los nudos de una red cristalina. Un sólido tiene en ausencia de fuerzas externas un volumen fijo y una forma determinada. Los átomos y moléculas vibran, alrededor de sus posiciones de equilibrio estable, cada vez con mayor amplitud a medida que se incrementa la temperatura. Llega un momento en el que vencen a las fuerzas de atracción que mantienen a los átomos en sus posiciones fijas y el sólido se convierte en líquido. Los átomos y moléculas siguen unidos por las fuerzas de atracción, pero pueden moverse unos respecto de los otros, lo que hace que los líquidos se adapten al recipiente que los contiene pero mantengan un volumen constante. Cuando se incrementa aún más la temperatura, se vencen las fuerzas de atracción que mantienen unidos a los átomos y moléculas en el líquido. Las moléculas están alejadas unas de las otras, se pueden mover por todo el recipiente que las contiene y solamente interaccionan cuando están muy próximas entre sí, en el momento en el que chocan. Un gas adopta la forma del recipiente que lo contiene y tiende a ocupar todo el volumen disponible.
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
9
Un ejemplo clásico en el que se utilizan los conceptos de calor específico y calor latente es el siguiente: Determinar el calor que hay que suministrar para convertir 1g de hielo a - 20 ºC en vapor a 100ºC. Los datos son los siguientes: 1. Calor específico del hielo Ch = 2090 J/(kg K) 2. Calor de fusión del hielo Lf = 334·103 J/kg 3. Calor específico del agua C = 4180 J/(kg K) 4. Calor de vaporización del agua Lv = 2260·103 J/kg Etapas: 1. Se eleva la temperatura de 1g de hielo de -20ºC (253 K) a 0ºC (273 K) Q1 = 0.001·2090·(273-253) = 41.8 J
2. Se funde el hielo Q2 = 0.001·334·103=334 J
3. Se eleva la temperatura del agua de 0º C (273 K) a 100 ºC (373 K)
Q3 = 0.001·4180·(373-273)=418 J 4. Se convierte 1 g de agua a 100ºC en vapor a la misma temperatura Q4 = 0.001·2260·103=2260 J
El calor total Q =Q1+Q2 + Q3 + Q4 = 3053.8 J.
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
10
En la figura, que no se ha hecho a escala, se muestra cómo se va incrementando la temperatura a medida que se aporta calor al sistema. La vaporización del agua requiere de gran cantidad de calor como podemos observar en la gráfica y en los cálculos realizados en el ejemplo.
Resumen
•
Primera Ley de la Termodinámica
dU = dQ − dW Entalpía:
H = U + PV
Trabajo hecho por el Sistema: dW = PdV ó W = ∫ PdV
dQ , C p y C v es para indicar que dT la P, V u otra variable permanece constante durante el cambio de temperatura. Capacidad Calorífica (C):
C=
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
Capacidad Calorífica
Desde el punto de vista termodinámico, calor es una forma de energía que aparece en un proceso y cuyo origen no es mecánico. El Calor es, pues, una forma de energía en tránsito, es decir, es la forma bajo la cual se transfiere la energía calórica desde un cuerpo a otro por conducción, radiación, o convección. No solamente los cambios físicos y químicos pueden originar absorción de calor de un sistema, sino también el simple aumento de temperatura. El hecho de que dos o más sustancias tengan la misma temperatura no significa que sean térmicamente idénticas. Es un hecho experimental que masas iguales de sustancias distintas pueden requerir cantidades diferentes de calor para aumentar sus temperaturas en la misma cantidad. Para una transferencia infinitesimal de calor el aumento en la temperatura es proporcional al calor suministrado, es decir:
dQ ∼ dT
dQ = C ⋅ dT En otras palabras, decimos que cuando una cantidad de calor ∆Q se transfiere desde el sistema de mayor temperatura al sistema de menor temperatura: •
La cantidad de calor transferida es proporcional al cambio de temperatura ∆T , esto es: ∆Q ∼ ∆T
•
La constante de proporcionalidad C se denomina Capacidad Calorífica del sistema: ∆Q = C ⋅ ∆T
Donde C es el coeficiente de proporcionalidad, es decir, una constante y se llama la Capacidad Calorífica C del sistema. Una sustancia con una capacidad calorífica alta requerirá una mayor transferencia de calor para elevar su temperatura que una sustancia con una capacidad calorífica menor, para una masa dada. La Capacidad Calorífica C se puede expresar como el cuociente entre el calor absorbido ( dQ ) y la variación de temperatura ( dT ):
C=
dQ dT
Por consiguiente, la Capacidad Calorífica C de una sustancia es la cantidad de calor necesaria para elevar su temperatura en un grado (Celsius o Kelvin).
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
2
Por regla general, el calor se expresa en función de una unidad denominada caloría que se define como la cantidad de calor necesaria para elevar en 1 grado la temperatura de 1 gramo de agua de 15,5 a 16,5°C. De esta definición de caloría, resulta evidente que la capacidad calorífica de 1 gramo de agua, en la proximidad de los 15°C es igual a 1 caloría. Pero según Joule, esa cantidad de calor es equivalente a un trabajo mecánico de 4,184 J. Entonces, una caloría es igual a 4.184 J y el factor de conversión de unas unidades a otras se conoce como el equivalente mecánico del calor, a menudo representado por J. Así: J = 4,184 joule/cal En las unidades del Systems International (SI), la Capacidad Calorífica de un sistema es la cantidad de joules necesario para elevar la temperatura de un cuerpo en 1°K. La capacidad calorífica depende de: • la masa del cuerpo • de su composición química • de su estado termodinámico, y • del tipo de transformación durante la cual se le cede calor. La capacidad calorífica es una propiedad que es proporcional a la cantidad de sustancia presente y, por consiguiente, ésta se debe especificar: Calor Específico (c). Es la cantidad de calor necesaria que hay que suministrar a 1 gramo de una sustancia para que incremente su temperatura en 1 grado. El calor específico corresponde a la capacidad calorífica por unidad de masa (c = C/m). Capacidad Calorífica Molar: Es la cantidad de calor necesaria expresada en calorías, para aumentar en 1°C un mol de una sustancia. De acuerdo a las definiciones anteriores, se aprecia que la capacidad calorífica molar resulta del producto del calor específico por el peso molecular de una sustancia (gramo/mol). La fórmula para la transferencia de calor entre los cuerpos se expresa en términos de la masa m , del calor específico c y del cambio de temperatura ( ∆T ): ∆Q = mc∆T
∆Q = mc(T final − Tinicial ) Por tanto, la cantidad de calor liberado o absorbido por una sustancia es proporcional a su masa y a la variación de temperatura que experimenta y, además, depende de la naturaleza del material.
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
3
Las unidades en que normalmente se expresa la capacidad calorífica son joule caloría o . Por consiguiente resulta más mol ⋅ grado mol ⋅ grado conveniente emplear la capacidad calorífica molar que el calor específico. Debemos recordar que cada forma de energía se puede expresar como el producto de un factor de intensidad (propiedad intensiva) por un factor de capacidad (propiedad extensiva). De estas relaciones, tenemos que el cambio en el contenido calórico ( dQ ) experimentado por un mol de un sistema de calor específico molar C (propiedad extensiva) correspondiente a un cambio en la temperatura ( dT ) (propiedad intensiva) viene dado por: dQ = C ⋅ dT Puesto que la Capacidad Calorífica C es la cantidad de calor necesaria para producir una variación de temperatura de un grado, es evidente que el calor que se requiere para producir una variación de temperatura ∆T es: Q = C ⋅ ∆T = C ⋅ (T2 − T1 )
Dicho en otras palabras, la Capacidad Calorífica C de un cuerpo es la propiedad que, multiplicada por la variación de temperatura, da la cantidad de energía que ha tomado o cedido el cuerpo como calor cuando se pone en o con otro que tiene una temperatura diferente. Por lo tanto, si la temperatura del cuerpo sube de T1 a T2 al tomar una cantidad de calor Q , entonces la capacidad calorífica C del cuerpo viene dado por:
C=
Q Q = T2 − T1 ∆T
Sin embargo, hay una dificultad inmediata para poder aplicar esta ecuación, debido a que el calor no es una función de estado. Por consiguiente, el calor que interviene en un proceso está determinado, no solamente por los estados inicial y final, sino también por la forma en que se realiza el proceso. En esta ecuación nada se dice acerca de cómo varía la temperatura. Esta dificultad se puede evitar definiendo dos capacidades caloríficas molares: 1) Capacidad Calorífica para procesos a presión constante, , y 2) Capacidad Calorífica para procesos a volumen constante, Cv . Estas definiciones, en forma infinitesimal, son:
=
dQP dT
y
CV =
dQV dT
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
4
A partir de estas definiciones, el calor necesario para variar la temperatura de n moles de una sustancia desde T1 a T2 es:
QP =
T2
∫
n dT
Para un proceso a Presión Constante.
T1
T2
QV = ∫ nCV dT
Para un proceso a Volumen Constante.
T1
Para muchas sustancias en las proximidades de la temperatura ambiente, y Cv son constantes e independiente. En estas condiciones las dos ecuaciones anteriores se pueden integrar fácilmente para obtener: QP = n ⋅ ⋅ (T2 − T1 )
QV = n ⋅ CV ⋅ (T2 − T1 ) La capacidad calorífica a volumen constante generalmente es menor que a presión constante. La diferencia se debe que un sistema a presión constante puede expandirse por calentamiento, usando algo de calor transferido en hacer trabajo sobre los alrededores, mientras que a volumen constante toda la energía transferida produce un aumento en la temperatura. Relación entre C P y C V y las Funciones de Estado H y U , respectivamente De acuerdo con la Primera Ley: dU = dQrev − dWrev dQrev = dU + dWrev Pero: c =
dQrev dT
dQrev = cdT Por tanto:
cdT = dU + dWrev c =
(dU + dWrev ) dT
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
5
La capacidad calorífica definida así es claramente dependiente del tipo de proceso que se utilice para suministrar calor. Si el sistema realiza trabajo dWrev (es decir, PdV) la ecuación anterior se transforma en:
c =
(dU + PdV ) dT
(Ec. a)
Si durante el proceso de adición del calor, el volumen V se mantiene constante ( dV = 0 ) entonces la capacidad calorífica que se obtiene es aquella a volumen constante cv , donde:
⎛ dU ⎞ cv = ⎜ ⎟ ⎝ dT ⎠ Por consiguiente, para un proceso a volumen constante: ∆U = ∫ cv dT
Por otra parte, si usamos un proceso a presión constante para ceder el calor, y utilizamos la ecuación, notando que: H = U + PV
Diferenciando: pero dP = 0 ( P = cons tan te )
dH = dU + PdV + VdP
dU = dH − PdV
Obtendremos que la Ec. a se transforma en ese caso en:
=
(dH − PdV + PdV ) dT
⎛ dH ⎞ = ⎜ ⎟ ⎝ dT ⎠ Por consiguiente, para un proceso a presión constante:
∆Η = ∫ dT
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
6
Capacidad Calorífica para Gas Ideal Para un gas ideal la relación entre C P y C V es muy sencilla:
C P =C V + R Para demostrar esta relación basta combinar la ecuación de definición de entalpía con las definiciones de C P y C V : H = U + PV
Diferenciando con respecto a T:
dH dU d (PV ) = + dT dT dT C P = CV +
d (PV ) dT
Pero
PV = nRT
para n = 1
C P = CV +
por consiguiente:
C P = CV + R
d (RT ) dT
Para Problemas Geológicos Para los efectos de cálculo de problemas geológicos, la capacidad calorífica que usaremos es la que corresponde a un proceso a presión constante, es decir, c p . En este caso ∆c p , es decir, el cambio de capacidad calorífica en una reacción química entre productos y reactantes, puede asumir las siguientes situaciones:
•
∆c p = 0 , es decir la capacidad calorífica es independiente de la temperatura.
•
∆c p = constante, es decir, la capacidad calorífica no varía entre el intervalo de temperatura que interesa desarrollar la reacción química.
•
∆c p = función de la temperatura, es decir, debe utilizarse una ecuación que expresa la dependencia de C p con la
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
7
temperatura, a objeto de poder desarrollar la integral entre los intervalos de temperatura de interés. Así, las ecuaciones empíricas para evaluar C p pueden tomar distintas formas, por ejemplo:
= a + 2bT − cT −2 = a + bT + cT −2 = a + bT + cT 2 La ecuación empírica más utilizada es la de Maier-Kelley: c p = a + bT + cT −2
=
∫ (a + bT + cT )dT
T2
−2
T1
C p = a (T2 − T1 ) +
⎛1 b 2 1 ⎞ ⎟⎟ T2 − T12 − c⎜⎜ − 2 ⎝ T2 T1 ⎠
(
)
Efecto Joule-Thomson. En Física, el efecto de Joule-Thomson, es el proceso en el cual la temperatura de un sistema disminuye o aumenta al permitir que el sistema se expanda libremente manteniendo la entalpía constante. La relación entre temperatura, presión y volumen de un gas se puede describir de una forma sencilla gracias a las leyes de los gases. Cuando el volumen aumenta durante un proceso irreversible, las leyes de los gases no pueden determinar por si solas qué ocurre con la temperatura y presión del gas. En general, cuando un gas se expande adiabáticamente, la temperatura puede aumentar o disminuir, dependiendo de la presión y temperatura inicial. Para una presión constante (fijada previamente), un gas tendrá una temperatura de inversión de Joule-Thomson, sobre la cual al expandirse el gas causa un aumento de temperatura, y por debajo, la expansión del gas causa un enfriamiento. En la mayoría de los gases, a presión atmosférica esta temperatura es bastante alta, mucho mayor que la temperatura ambiental, y por ello la mayoría de los gases se enfrían al expandirse. El incremento de temperatura (∆T) con respecto al incremento de presión (∆p) en un proceso de Joule-Thomson es el coeficiente de Joule-Thomson (µ JT ) :
µ JT =
∆T ∆P
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
8
⎛ dT ⎞ Esta expresión se puede encontrar también escrita como µ JT = ⎜ ⎟ ⎝ dP ⎠ H
El valor de µJT depende del gas específico, tanto como la temperatura y la presión del gas antes de la expansión o compresión. Para gases reales esto será igual a cero en un mismo punto llamado punto de inversión y la temperatura de inversión Joule-Thomson es aquella donde el signo del coeficiente cambia.
Cambios de Estado Normalmente, una sustancia experimenta un cambio de temperatura cuando absorbe o cede calor al ambiente que le rodea. Sin embargo, cuando una sustancia cambia de estado o fase, tal como la vaporización de un líquido, la fusión o sublimación de un sólido, y la transición polimórfica de una estructura cristalina a otra, va acompañada de una absorción o liberación de calor sin que se produzca un cambio de su temperatura. El calor Q que es necesario aportar para que una masa m de cierta sustancia cambie de fase es igual a:
Q = mL donde L se denomina calor latente de la sustancia y depende del tipo de cambio de fase. Por ejemplo, para que el agua cambie de sólido (hielo) a líquido, a 0ºC se necesitan 334·103 J/kg. Para que cambie de líquido a vapor a 100 ºC se precisan 2260·103 J/kg. Los cambios de estado se pueden explicar de forma cualitativa del siguiente modo: En un sólido los átomos y moléculas ocupan las posiciones fijas de los nudos de una red cristalina. Un sólido tiene en ausencia de fuerzas externas un volumen fijo y una forma determinada. Los átomos y moléculas vibran, alrededor de sus posiciones de equilibrio estable, cada vez con mayor amplitud a medida que se incrementa la temperatura. Llega un momento en el que vencen a las fuerzas de atracción que mantienen a los átomos en sus posiciones fijas y el sólido se convierte en líquido. Los átomos y moléculas siguen unidos por las fuerzas de atracción, pero pueden moverse unos respecto de los otros, lo que hace que los líquidos se adapten al recipiente que los contiene pero mantengan un volumen constante. Cuando se incrementa aún más la temperatura, se vencen las fuerzas de atracción que mantienen unidos a los átomos y moléculas en el líquido. Las moléculas están alejadas unas de las otras, se pueden mover por todo el recipiente que las contiene y solamente interaccionan cuando están muy próximas entre sí, en el momento en el que chocan. Un gas adopta la forma del recipiente que lo contiene y tiende a ocupar todo el volumen disponible.
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
9
Un ejemplo clásico en el que se utilizan los conceptos de calor específico y calor latente es el siguiente: Determinar el calor que hay que suministrar para convertir 1g de hielo a - 20 ºC en vapor a 100ºC. Los datos son los siguientes: 1. Calor específico del hielo Ch = 2090 J/(kg K) 2. Calor de fusión del hielo Lf = 334·103 J/kg 3. Calor específico del agua C = 4180 J/(kg K) 4. Calor de vaporización del agua Lv = 2260·103 J/kg Etapas: 1. Se eleva la temperatura de 1g de hielo de -20ºC (253 K) a 0ºC (273 K) Q1 = 0.001·2090·(273-253) = 41.8 J
2. Se funde el hielo Q2 = 0.001·334·103=334 J
3. Se eleva la temperatura del agua de 0º C (273 K) a 100 ºC (373 K)
Q3 = 0.001·4180·(373-273)=418 J 4. Se convierte 1 g de agua a 100ºC en vapor a la misma temperatura Q4 = 0.001·2260·103=2260 J
El calor total Q =Q1+Q2 + Q3 + Q4 = 3053.8 J.
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra
10
En la figura, que no se ha hecho a escala, se muestra cómo se va incrementando la temperatura a medida que se aporta calor al sistema. La vaporización del agua requiere de gran cantidad de calor como podemos observar en la gráfica y en los cálculos realizados en el ejemplo.
Resumen
•
Primera Ley de la Termodinámica
dU = dQ − dW Entalpía:
H = U + PV
Trabajo hecho por el Sistema: dW = PdV ó W = ∫ PdV
dQ , C p y C v es para indicar que dT la P, V u otra variable permanece constante durante el cambio de temperatura. Capacidad Calorífica (C):
C=
Apuntes de Clases. Curso Fisicoquímica Mineralógica. Prof. N. Guerra