Capacidad Calorifica Del Aire 3i5y6j
This document was ed by and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this report form. Report 3b7i
Overview 3e4r5l
& View Capacidad Calorifica Del Aire as PDF for free.
More details w3441
- Words: 1,298
- Pages: 7
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN FACULTAD DE INGENIERIA CIVIL, ARQUITECTURA Y GEOTECNIA ESCUELA ACADEMICA PROFESIONAL DE INGENIERIA GEOLOGICA-GEOTECNIA
TERMODINAMICA PRACTICA DE LABORATORIO: Capacidad Calorífica del Aire
RESPONSABLE
:
VILOCHE BAZAN, JUAN
ALUMNO
:
JHONATHAN FERNANDEZ TORRES
CODIGO
:
2012-37011
TACNA – PERU Capacidad calorífica del aire 1. Objetivos.-
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
Determinar experimentalmente el
γ
2. Fundamento teórico: Ley de Boyle.- Es llamada ley de las isotermas, porque durante el fenómeno que relata, la temperatura de la masa de gas permanece constante. Se enuncia en la forma siguiente: “Manteniendo constante la temperatura de una masa de un gas, los volúmenes que puede presentar están en razón inversa de las presiones que soportan.” O sea, que si el gas pasa de las condiciones 1 a las condiciones 2, se tendrá:
V 1 P2 = V 2 P1
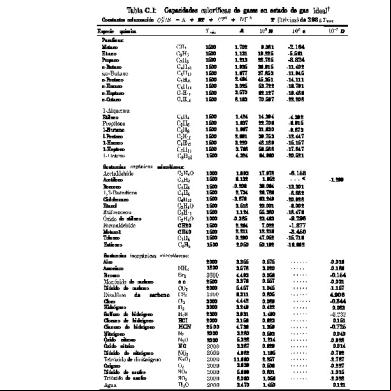
Capacidades caloríficas molares de los gases.- se llama capacidad calorífica de cualquier sistema, a la cantidad de calor requerida para elevar en un grado la temperatura del sistema. Si la masa del material es un mol se le designa como capacidad calorífica molar y si es un gramo se llama calor específico. En gases usaremos las capacidades caloríficas molares, las cuales son de los dos tipos siguientes: 1. A volumen constante, (CV) cuando el volumen se mantiene constante mientras se eleva la temperatura, lo que da origen a que aumente la presión del gas. El calentamiento se realiza en recipiente cerrado. 2. A presión constante, () cuando la presión se mantiene constante mientras se eleva la temperatura, lo que da origen a que aumente el volumen del gas. El calentamiento se realiza en recipiente abierto La relación γ entre las dos capacidades caloríficas molares de cualquier gas que solo posee energía de traslación es de 1.67. esta conclusión se aplica únicamente a los gases monoatómicas.
γ=
CV
Capacidades Caloríficas Molares de Gases y Vapores Monoatómicos GAS Helio Argón Mercurio
5.00 4.98 4.97
CV 3.02 2.99 2.98
γ 1.66 1.67 1.67
PAG. 2
Capacidades Caloríficas Molares de Gases Diatomicos
LABORATORIO – TERMODINAMICA
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
Gas Hidrogeno Oxigeno Nitrógeno Cloro Oxido de Carbono Cloruro deHidrogeno
Formula H2 O2 N2 Cl2
6.90 7.05 6.94 8.25
CV 4.91 5.05 4.95 6.14
γ 1.41 1.40 1.40 1.34
CO
6.97
4.97
1.40
HCl
7.05
5.01
1.41
Procesos Adiabáticos.- Con frecuencia ocurren procesos en los cuales no hay ningún intercambio de calor con los sistemas limitantes, debido a que el sistema está aislado o se trata de procesos muy rápidos. Estos procesos se llaman adiabáticos y pueden ser efectuados en forma reversible. La característica de un proceso adiabático es que q=0. Entonces reemplazando en el primer principio de termodinámica tendremos que:
∆ E=w O lo que es lo mismo, el trabajo w hecho sobre el sistema es igual al aumento de su energía interna. Por esta identificación a una propiedad de estado, resulta el trabajo adiabático una cantidad definida que es independiente del camino. En una comprensión adiabática, por el aumento en la energía interna, el gas eleva su temperatura, es decir se calienta. Por el contrario en una expansión adiabática de un gas el sistema efectuara un trabajo contra la presión exterior y desde que no toma calor del medio ambiente, la energía necesaria provendrá de la energía cinética de sus moléculas, cuya disminución originara una caída en la temperatura del gas es decir su enfriamiento.
Relaciones P-V-T y valore del trabajo en los procesos isotérmicos
PAG. 3
y adiabáticos
LABORATORIO – TERMODINAMICA
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
Las curvas que representan la variación de P en función de V poseen una pendiente mayor en los procesos adiabáticos que en los isotérmicos, como se observa en la figura. Cuando un gas se expande adiabáticamente de un volumen V 1 a otro volumen V2, la caída de presión es mayor en el proceso adiabático según la figura (1), debido a que el gas se enfría. Al contrario, en cualquier comprensión adiabática de un gas, como este se calienta, la presión aumenta más rápidamente, lo que se ve en la figura (2), por lo cual se gasta más trabajo para producir una determinada reduce volumen de V 1 y V2, que si fuera isotérmica 3. Materiales: Vasija de vidrio Manómetro de agua Llaves de vidrio de cierre hermético Bomba pera goma Tapón Manguera
Manómetro
Vasija de vidrio Manguera Bomba de pera de goma
4. Parte experimental: Con la llave C cerrada, se impele aire con la bomba (pera de goma) hasta una cierta presión P1 (Fig.2a); la temperatura sube hasta T 1 por el calor generado durante la pequeña compresión. Cerrando ahora la llave de la bomba, se esperan unos minutos para que vuelva a la temperatura ambiente T a otra vez (Fig.2b). Durante este proceso la presión baja hasta el valor P 1=ha+∆h1. Ahora se realiza la expansión adiabática abriendo la llave C durante un intervalo de breve tiempo (Fig.2c), el mínimo posible para recuperar la presión Pa (∆P=0). Como son secuencia el aire interior se enfría ligeramente. Después de unos minutos, el aire interior recupera la temperatura ambiente y la presión sube hasta el valor final P3=ha+∆h3(Fig.2d)
LABORATORIO – TERMODINAMICA
PAG. 4
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
P 1
5. Cálculos y resultados Calculando la altura del agua (H2O):
g × ρ Hg × hHg =g× ρ H 2 O × hH 2 O 13.6 ×71.5=1 × hH 2 O h H 2O =972.4
Para poder calcular las presiones correspondientes se emplea :
P1=h2 +h1
P2=h2 P3=h2 +h 3
Recordar que la capacidad calorífica del aire nos debe de salir 1.4; para hallar la capacidad calorífica del aire:
γ=
lnP1 −lnP2 lnP1 −lnP3 LABORATORIO – TERMODINAMICA
PAG. 5
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
h1=43.5 h3=11.4
Reemplazando los valores calculados por el profesor
P1=972.4 +43.5=1015.9 P2=h2 =972.4 P3=h2 +h 3=972.4+ 11.4=983.8
γ=
ln ( 1015.9)−ln ( 972.4) =1.3630 ln ( 1015.9)−ln ( 983.8)
Ahora procedimos a tomar datos pero calculados por el alumnado del salón. Y se tomaron 4 lecturas. Que se procedió a promediar para calcular la capacidad calorífica del aire. o DATO1:
P1=h2 +h1 =972.4+ 43=1015.4 P2=h2 =972.4 P3=h2 +h 3=972.4+ 10.5=982.9 γ=
lnP1 −lnP2 ln ( 1015.4 )−ln ( 972.4 ) = =1.3301 lnP1 −lnP3 ln ( 1015.4 ) −ln ( 982.9 ) o
DATO2:
P1=h2 +h1 =972.4+22.9=995.3 P2=h2 =972.4 P3=h2 +h 3=972.4+ 4.8=977.2
γ=
lnP1 −lnP2 ln (995.3)−ln ( 972.4) = =1.2683 lnP1 −lnP3 ln ( 995.3)−ln ( 977.2)
o
DATO3:
P1=h2 +h1 =972.4+27=999.4 P2=h2 =972.4 P3=h2 +h 3=972.4+ 5.8=978.2 γ=
lnP1 −lnP2 ln (999.4)−ln ( 972.4) = =1.2773 lnP1 −lnP3 ln ( 999.4)−ln ( 978.2) PAG. 6
o
DATO4:
P1=h2 +h1 =972.4+ 44.5=1016.9 LABORATORIO – TERMODINAMICA
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
P2=h2 =972.4 P3=h2 +h 3=972.4+ 9.2=981.6 γ=
lnP1 −lnP2 ln (1016.9)−ln (972.4) = =1.2665 lnP1 −lnP3 ln ( 1016.9)−ln (981.6)
Sacando el promedio de los 4 datos obtenemos:
γ=
1.3301+ 1.2683+ 1.2773+ 1.2665 =1.2856 4
6. CONCLUSIONES: Para poder realizar un proceso adiabático no debe de haber ningún intercambio de calor con los sistemas limitantes. Es por eso que se realizó en una vasija de vidrio ya que el sistema debe estar aislado. El proceso adiabático se trata de un procesos muy rápido es por eso que el tapón de la vasija se abrió y se tapó rápidamente para poder realizar. La gases diatónicos tiene una relación entre sus capacidades caloríficas de 1.4 También los procesos adiabáticos pueden ser efectuados en forma reversible. 7. BIBLIOGRAFÍA:
PAGINAS: es.wikipedia.org http://es.wikipedia.org/wiki/Presi%C3%B3n_en_un_fluido http://es.wikipedia.org/wiki/Presi%C3%B3n_manom%C3%A9trica http://es.wikipedia.org/wiki/Sif%C3%B3n
LIBROS: Fisicoquímica, sexta edición 1985 (Gastón Pons Muzzo) Química. Análisis de principios y aplicaciones Tomo I, 2009 (Instituto de ciencias y humanidades
PAG. 7
LABORATORIO – TERMODINAMICA
TERMODINAMICA PRACTICA DE LABORATORIO: Capacidad Calorífica del Aire
RESPONSABLE
:
VILOCHE BAZAN, JUAN
ALUMNO
:
JHONATHAN FERNANDEZ TORRES
CODIGO
:
2012-37011
TACNA – PERU Capacidad calorífica del aire 1. Objetivos.-
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
Determinar experimentalmente el
γ
2. Fundamento teórico: Ley de Boyle.- Es llamada ley de las isotermas, porque durante el fenómeno que relata, la temperatura de la masa de gas permanece constante. Se enuncia en la forma siguiente: “Manteniendo constante la temperatura de una masa de un gas, los volúmenes que puede presentar están en razón inversa de las presiones que soportan.” O sea, que si el gas pasa de las condiciones 1 a las condiciones 2, se tendrá:
V 1 P2 = V 2 P1
Capacidades caloríficas molares de los gases.- se llama capacidad calorífica de cualquier sistema, a la cantidad de calor requerida para elevar en un grado la temperatura del sistema. Si la masa del material es un mol se le designa como capacidad calorífica molar y si es un gramo se llama calor específico. En gases usaremos las capacidades caloríficas molares, las cuales son de los dos tipos siguientes: 1. A volumen constante, (CV) cuando el volumen se mantiene constante mientras se eleva la temperatura, lo que da origen a que aumente la presión del gas. El calentamiento se realiza en recipiente cerrado. 2. A presión constante, () cuando la presión se mantiene constante mientras se eleva la temperatura, lo que da origen a que aumente el volumen del gas. El calentamiento se realiza en recipiente abierto La relación γ entre las dos capacidades caloríficas molares de cualquier gas que solo posee energía de traslación es de 1.67. esta conclusión se aplica únicamente a los gases monoatómicas.
γ=
CV
Capacidades Caloríficas Molares de Gases y Vapores Monoatómicos GAS Helio Argón Mercurio
5.00 4.98 4.97
CV 3.02 2.99 2.98
γ 1.66 1.67 1.67
PAG. 2
Capacidades Caloríficas Molares de Gases Diatomicos
LABORATORIO – TERMODINAMICA
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
Gas Hidrogeno Oxigeno Nitrógeno Cloro Oxido de Carbono Cloruro deHidrogeno
Formula H2 O2 N2 Cl2
6.90 7.05 6.94 8.25
CV 4.91 5.05 4.95 6.14
γ 1.41 1.40 1.40 1.34
CO
6.97
4.97
1.40
HCl
7.05
5.01
1.41
Procesos Adiabáticos.- Con frecuencia ocurren procesos en los cuales no hay ningún intercambio de calor con los sistemas limitantes, debido a que el sistema está aislado o se trata de procesos muy rápidos. Estos procesos se llaman adiabáticos y pueden ser efectuados en forma reversible. La característica de un proceso adiabático es que q=0. Entonces reemplazando en el primer principio de termodinámica tendremos que:
∆ E=w O lo que es lo mismo, el trabajo w hecho sobre el sistema es igual al aumento de su energía interna. Por esta identificación a una propiedad de estado, resulta el trabajo adiabático una cantidad definida que es independiente del camino. En una comprensión adiabática, por el aumento en la energía interna, el gas eleva su temperatura, es decir se calienta. Por el contrario en una expansión adiabática de un gas el sistema efectuara un trabajo contra la presión exterior y desde que no toma calor del medio ambiente, la energía necesaria provendrá de la energía cinética de sus moléculas, cuya disminución originara una caída en la temperatura del gas es decir su enfriamiento.
Relaciones P-V-T y valore del trabajo en los procesos isotérmicos
PAG. 3
y adiabáticos
LABORATORIO – TERMODINAMICA
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
Las curvas que representan la variación de P en función de V poseen una pendiente mayor en los procesos adiabáticos que en los isotérmicos, como se observa en la figura. Cuando un gas se expande adiabáticamente de un volumen V 1 a otro volumen V2, la caída de presión es mayor en el proceso adiabático según la figura (1), debido a que el gas se enfría. Al contrario, en cualquier comprensión adiabática de un gas, como este se calienta, la presión aumenta más rápidamente, lo que se ve en la figura (2), por lo cual se gasta más trabajo para producir una determinada reduce volumen de V 1 y V2, que si fuera isotérmica 3. Materiales: Vasija de vidrio Manómetro de agua Llaves de vidrio de cierre hermético Bomba pera goma Tapón Manguera
Manómetro
Vasija de vidrio Manguera Bomba de pera de goma
4. Parte experimental: Con la llave C cerrada, se impele aire con la bomba (pera de goma) hasta una cierta presión P1 (Fig.2a); la temperatura sube hasta T 1 por el calor generado durante la pequeña compresión. Cerrando ahora la llave de la bomba, se esperan unos minutos para que vuelva a la temperatura ambiente T a otra vez (Fig.2b). Durante este proceso la presión baja hasta el valor P 1=ha+∆h1. Ahora se realiza la expansión adiabática abriendo la llave C durante un intervalo de breve tiempo (Fig.2c), el mínimo posible para recuperar la presión Pa (∆P=0). Como son secuencia el aire interior se enfría ligeramente. Después de unos minutos, el aire interior recupera la temperatura ambiente y la presión sube hasta el valor final P3=ha+∆h3(Fig.2d)
LABORATORIO – TERMODINAMICA
PAG. 4
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
P 1
5. Cálculos y resultados Calculando la altura del agua (H2O):
g × ρ Hg × hHg =g× ρ H 2 O × hH 2 O 13.6 ×71.5=1 × hH 2 O h H 2O =972.4
Para poder calcular las presiones correspondientes se emplea :
P1=h2 +h1
P2=h2 P3=h2 +h 3
Recordar que la capacidad calorífica del aire nos debe de salir 1.4; para hallar la capacidad calorífica del aire:
γ=
lnP1 −lnP2 lnP1 −lnP3 LABORATORIO – TERMODINAMICA
PAG. 5
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
h1=43.5 h3=11.4
Reemplazando los valores calculados por el profesor
P1=972.4 +43.5=1015.9 P2=h2 =972.4 P3=h2 +h 3=972.4+ 11.4=983.8
γ=
ln ( 1015.9)−ln ( 972.4) =1.3630 ln ( 1015.9)−ln ( 983.8)
Ahora procedimos a tomar datos pero calculados por el alumnado del salón. Y se tomaron 4 lecturas. Que se procedió a promediar para calcular la capacidad calorífica del aire. o DATO1:
P1=h2 +h1 =972.4+ 43=1015.4 P2=h2 =972.4 P3=h2 +h 3=972.4+ 10.5=982.9 γ=
lnP1 −lnP2 ln ( 1015.4 )−ln ( 972.4 ) = =1.3301 lnP1 −lnP3 ln ( 1015.4 ) −ln ( 982.9 ) o
DATO2:
P1=h2 +h1 =972.4+22.9=995.3 P2=h2 =972.4 P3=h2 +h 3=972.4+ 4.8=977.2
γ=
lnP1 −lnP2 ln (995.3)−ln ( 972.4) = =1.2683 lnP1 −lnP3 ln ( 995.3)−ln ( 977.2)
o
DATO3:
P1=h2 +h1 =972.4+27=999.4 P2=h2 =972.4 P3=h2 +h 3=972.4+ 5.8=978.2 γ=
lnP1 −lnP2 ln (999.4)−ln ( 972.4) = =1.2773 lnP1 −lnP3 ln ( 999.4)−ln ( 978.2) PAG. 6
o
DATO4:
P1=h2 +h1 =972.4+ 44.5=1016.9 LABORATORIO – TERMODINAMICA
UNIVERSIDAD NACIONAL JORGE BASADRE GROHMANN
P2=h2 =972.4 P3=h2 +h 3=972.4+ 9.2=981.6 γ=
lnP1 −lnP2 ln (1016.9)−ln (972.4) = =1.2665 lnP1 −lnP3 ln ( 1016.9)−ln (981.6)
Sacando el promedio de los 4 datos obtenemos:
γ=
1.3301+ 1.2683+ 1.2773+ 1.2665 =1.2856 4
6. CONCLUSIONES: Para poder realizar un proceso adiabático no debe de haber ningún intercambio de calor con los sistemas limitantes. Es por eso que se realizó en una vasija de vidrio ya que el sistema debe estar aislado. El proceso adiabático se trata de un procesos muy rápido es por eso que el tapón de la vasija se abrió y se tapó rápidamente para poder realizar. La gases diatónicos tiene una relación entre sus capacidades caloríficas de 1.4 También los procesos adiabáticos pueden ser efectuados en forma reversible. 7. BIBLIOGRAFÍA:
PAGINAS: es.wikipedia.org http://es.wikipedia.org/wiki/Presi%C3%B3n_en_un_fluido http://es.wikipedia.org/wiki/Presi%C3%B3n_manom%C3%A9trica http://es.wikipedia.org/wiki/Sif%C3%B3n
LIBROS: Fisicoquímica, sexta edición 1985 (Gastón Pons Muzzo) Química. Análisis de principios y aplicaciones Tomo I, 2009 (Instituto de ciencias y humanidades
PAG. 7
LABORATORIO – TERMODINAMICA